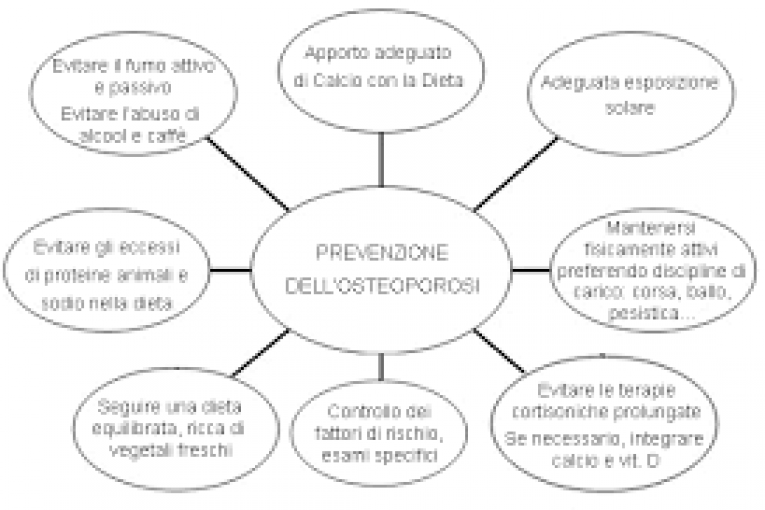
L’osteoporosi è una malattia cronico-degenerativa caratterizzata da bassa densità di massa ossea (Bone Mass Density, BMD) associata a fratture scheletriche secondarie. La diminuzione della BMD è la conseguenza di uno sbilanciamento del processo di osteogenesi con la prevalenza del riassorbimento osseo rispetto alla formazione ossea. L’osteoporosi colpisce prevalentemente le donne in post-menopausa ma anche gli uomini più anziani ed è spesso associata con l’ipotiroidismo. L’osteoporosi è una malattia multifattoriale associata a fattori di rischio endogeni (corredo genetico, ormoni, sesso, razza)ed esogeni come gli stili di vita. Tra questi ultimi, l’attività fisica gioca un ruolo cruciale, sia nell’incrementare la BMD fino al raggiungimento del picco ottimale di massa ossea (Bone Mass Peak, BMP) sia nel contrastare la riduzione della BMD che fisiologicamente si verifica nel corso degli anni. Questo rapporto presenta una rassegna delle evidenze e delle conoscenze scientifiche sul ruolo dell’attività fisica nella prevenzione e cura dell’osteoporosi.
…………
ATTIVITÀ FISICA E OSTEOPOROSI
L’importanza della associazione tra inattività fisica e osteoporosi è stata evidenziata da varie ricerche che hanno indicato che, le fratture osteoporotiche, principalmente quelle dell’anca, sono le fratture maggiormente riscontrabili in persone con uno stile di vita più sedentario rispetto alle persone che conducono una vita più attiva. Ad esempio, le donne che siedono per più di 9 ore al giorno hanno il 50% in più di probabilità ad avere una frattura dell’anca rispetto a quelle che siedono meno di sei ore al giorno (40). In particolare, le ricerche hanno mostrato che gli adulti con vita sedentaria hanno una perdita del 3-8% di massa muscolare ogni decennio, accompagnata da riduzione di velocità metabolica e di accumulo di grasso, mentre chi fa esercizio fisico favorisce lo sviluppo delle ossa aumentando la BMD dell’1-3%. Inoltre, l’attività fisica nelle donne in post-menopausa aumenta la BMD, negli anziani riduce la perdita della BMD e durante la crescita e adolescenza promuove aumenti di BMD in quelle regioni dello scheletro dove si esercita il peso e il carico come la colonna vertebrale e il collo del femore (41).
Questo evidenzia che l’attività fisica ha un ruolo cruciale sull’osso, sia nell’incrementare la BMD fino al raggiungimento di un buon BMP, sia nel ridurre la percentuale della BMD che fisiologicamente diminuisce nel corso degli anni anche se, in presenza di osteoporosi, si potrebbe pensare erroneamente che l’esercizio stesso possa portare alle fratture. Inoltre, si deve ricordare che la crescita di BMD, caratteristica di ciascun individuo, è un processo naturale che raggiunge l’acme intorno ai 16-18 anni per le femmine e 20-22 anni per i maschi; pertanto, per chi vuole migliorare la sua massa ossea deve concentrarsi maggiormente
su infanzia e adolescenza (11). Per avvalorare importanza dell’esercizio fisico nel raggiungimento di BMP per ottimizzare i livelli di BMD al fine di ridurre il rischio di sviluppare l’osteoporosi in età avanzata, l’American Society for Bone and Mineral Research ha pubblicato un importante studio svedese (42) eseguito su larga scala in giovani adulti (1068 uomini con una età media di 24 anni), indicando che l’aumento dell’attività fisica, per un periodo di oltre 5 anni, è associato a: ‒ un aumento generale del contenuto minerale osseo (Bone Mineral Content, BMC) basato principalmente sul contenuto di calcio e di fosforo, essenziali minerali nelle fasi di crescita e/o rafforzamento;
‒ un incremento di BMD areale (aBMD) dell’anca e della colonna lombare dovuto all’aumento volumetrico (vBMD) dell’osso corticale e trabecolare (p < 0,001);
‒ un vantaggioso sviluppo nella grandezza dell’area corticale e nella densità dell’osso trabecolare della tibia (p < 0,001).
La colonna lombare, l’anca e la tibia sono le principali parti dello scheletro che lo studio ha preso come riferimento di sviluppo e consolidamento delle ossa; in particolare, la BMC e la aBMD venivano misurate mediante l’assorbimetria a raggi X a doppia energia (Dual Energy Xray Absorptiometry, DEXA), mentre la vBMD e la grandezza dell’osso erano misurate mediante la tomografia computerizzata quantitativa periferica (peripheral Quantitative Computed Tomography, pQCT) (42).
In breve la DEXA è una tecnica specifica di cui si avvale la Mineralometria Ossea Computerizzata (MOC) per misurare la BMC e la BMD cioè per misurare la quantità e la densità di sali minerali (sali di calcio) contenuti nello scheletro. La MOC-DEXA, la più utilizzata, si basa sul principio dell’attenuazione differenziata di un fascio di raggi X a due livelli energetici nell’attraversare i tessuti del corpo umano; questa attenuazione è registrabile ed è correlata alla composizione corporea del soggetto esaminato. L’apparecchio utilizza un piccolissimo fascio di raggi X a dosi molto basse con assenza di dispersione nell’ambiente. La pQCT è una Tomografia Assiale Computerizzata (TAC) quantitativa delle ossa periferiche con cui si studiano particolarmente le ossa degli arti come radio e tibia ed è questa l’unica tecnica non invasiva che studia la reale densità di tessuto osseo in un dato volume in mg/cm3 senza la sovrapposizione di altri tessuti; la densità ossea può essere calcolata separatamente nella componente trabecolare e corticale o calcolate insieme. L’importanza della conoscenza di raggiungere tale ottimizzazione è dovuta essenzialmente al fatto che per l’osteoporosi, non vi è attualmente né una terapia preventiva né una terapia che garantisce un recupero ideale, pur esistendo ottime terapie curative come già indicato. Questo ribadisce, con grande enfasi, la necessità della prevenzione della malattia con l’attuazione di strategie efficaci, come gli esercizi fisici, che consolidano e/o migliorano lo stato dell’osso durante la crescita (43). Un regolare esercizio fisico non solo rafforza le ossa, aiutando a prevenire l’osteoporosi, ma se si è già in presenza di osteoporosi, l’esercizio può contribuire a mantenere la massa ossea; questo è supportato da studi di correlazione positiva tra attività fisica, forza muscolare e BMD (41). Tuttavia, alcune ricerche hanno considerato le possibili variabili individuali come l’età, il sesso e l’attività ormonale che possono interferire su tale correlazione (44). Inoltre, è importante tenere presente che, per il raggiungimento e mantenimento di buoni livelli di BMP, i fattori genici condizionano del 70-80% i livelli di massa ossea, mentre per il 20-30% rivestono notevole importanza altri fattori e, tra i più noti, ricordiamo la carenza di calcio e di vitamina D (45).
…………………………..
Esercizio fisico e ormoni sessuali
Per comprendere come l’attività fisica agisce indirettamente sul metabolismo anabolico e catabolico del segnale nelle cellule ossee, si deve ricordare che i fattori di rischio endogeni diosteoporosi sono identificati come locali e sistemici che, pur non essendo modificabili, possono interagire con quelli esogeni modificabili come gli stili di vita (25). Questa interazione è particolarmente importante negli adulti donne (62) e uomini (63) in cui avvengono importanti cambiamenti ormonali. Per tale motivo gli stili di vita, come l’attività fisica, hanno un ruolo significativo nell’interferire sul meccanismo d’azione degli ormoni sessuali steroidei (estrogeni, progestinici, androgeni). Gli ormoni sessuali sono molecole determinanti per la qualità della salute sia della cartilagine che dell’osso in quanto hanno la capacità di regolare la meccano-trasduzione e, pertanto, di controllare indirettamente il metabolismo del tessuto osseo (64).
Il calo fisiologico dei livelli di estrogeni durante la menopausa sono considerati come una delle principali cause di perdita di massa ossea età-dipendente, determinato, in primo luogo, da un aumentato riassorbimento osseo da parte degli osteoclasti.
Ciò è evidente nelle donne di mezza età, nelle quali la classica terapia sostitutiva ormonale estrogenica (Hormone-Replacement Therapies, HRT), può essere una parte di una strategia globale per prevenire l’osteoporosi nel periodo peri-menopausale. Tuttavia, The Women’s Health Initiative non raccomanda la terapia ormonale, come una strategia di prevenzione assoluta per affrontare i danni che la carenza di estrogeni può causare, oltre al tessuto osseo, alle molte altre malattie croniche (65). Tale posizione si basa, soprattutto, sul fatto che la terapia estrogenica può provocare un aumento del rischio di cancro al seno dopo 3-5 anni di utilizzo (66).
Per ovviare ai potenziali rischi associati alla terapia sostitutiva sono state proposte strategie alternative per il trattamento dell’osteoporosi in post-menopausa che hanno previsto l’uso di modulatori selettivi del recettore estrogenico (Selective Estrogen Receptor Modulators, SERM). I SERM (es. raloxifene, tamoxifene) sono un gruppo eterogeneo di composti non steroidei che funzionano, in modo gene-specifico e tessuto-specifico, come agonisti o antagonisti dei recettori estrogenici (Estrogen Receptors, ER), presenti nelle cellule bersaglio. I SERM hanno dimostrato di avere gli stessi benefici mostrati dagli estrogeni sulle ossa, senza però causare effetti negativi al seno e all’endometrio (67). In particolare, Il raloxifene è una molecola non steroidea chimicamente correlata e analoga al tamoxifene (capostipite delle molecole con attività estrogenica di tipo agonista/antagonista) che ha evidenziato una selettività tissutale, con antagonismo su utero e mammella (inibendo la proliferazione dell’epitelio mammario e dell’endometrio) e agonismo su osso e metabolismo lipidico (preservando la densità minerale ossea e mostrando un effetto ipolipemizzante). Un tale profilo farmacologico indica un potenziale effetto antiosteoporotico e cardioprotettore simile a quello degli estrogeni, in assenza di rischio per il carcinoma della mammella e/o dell’utero (68).
Ricerche hanno indicato che i SERM, sono particolarmente indicati per la cura della malattia osteoporotica legata ai fattori di rischio di tipo esogeni come gli stili di vita. Uno stile di vita non adeguato, come la dieta ricca di zuccheri e/o di lipidi, influisce negativamente sulla qualità della massa ossea in quanto determina l’accumulo di mediatori critici pro-infiammatori di stress
ossidativo come gli AGE nel collagene (di cui si è già parlato).
L’aumento degli AGE è rilevabili dai livelli elevati di omocisteina e pentosidina serica e vengono ampiamente utilizzati come marker di modificazioni ossidative; in particolare, il raloxifene agisce mediante legami incrociati con l’omocisteina accumulata nel collagene. Questo porta a valutare che i SERM possono essere attualmente considerati efficaci agenti terapeutici nel controllare la presenza di AGE (69) e, perciò, di controllo del danno al tessuto osseo.
Questo suggerisce ulteriormente l’importanza dell’attività fisica che, agendo positivamente sulla dieta ricca di zuccheri e/o di lipidi, può rendere più efficace l’effetto anti-riassorbimento dei SERM. Intervenendo con l’esercizio fisico nelle donne in menopausa in terapia con i SERM, si possono riscontrare già, dopo 6 mesi, gli effetti positivi dell’esercizio sulla BMD (70).
Per evidenziare l’efficacia dell’esercizio fisico sugli ormoni steroidei, numerosi studi in vivo hanno valutato come tali esercizi possono influenzare i pathway della steroidogenesi. Una ricerca eseguita su animali da laboratorio ha dimostrato che un allenamento fisico, di lunga durata, conduce all’aumento della steroidogenesi nel muscolo scheletrico contenente gli enzimi (es. 5α-riduttasi, aromatasi) che sintetizzano gli ormoni sessuali steroidi. Lo studio, evidenziando l’aumento delle concentrazioni degli enzimi steroidogenici e degli ormoni sessuali dei muscoli scheletrici, ha sottolineato che gli esercizi di resistenza (di cui si parlerà poi) incrementano la concentrazione di DHT (dihydrotestosterone) muscolare attraverso la 5α-riduttasi muscolare. Questo suggerisce che il metabolismo degli androgeni locali, bioattivato dalla 5α-riduttasi, può partecipare nell’adattamento della muscolatura scheletrica all’allenamento fisico (71). Studi clinici hanno indicato che le donne in post-menopausa, nonostante il basso livello di ormoni steroidei circolanti, hanno un’alta concentrazione locale di enzimi steroidogenici nel muscolo scheletrico (72) confermando, ulteriormente, la necessità di fare attività fisica per questa fascia di popolazione alfine di stimolare tali enzimi; anche in combinazione con la
terapia agonista dei SERM. In conclusione, l’attività fisica può quindi preservare la salute dell’osso modulando gli ormoni sessuali, sia agendo indirettamente sui ER mediante l’attività agonista/antagonista dei SERM, che direttamente sulla steroidogenesi attraverso la 5α-riduttasi muscolare.
ULTERIORI EFFETTI DELL’ATTIVITÀ FISICA SUL TESSUTO OSSEO
L’attività fisica, oltre a promuovere effetti diretti sul tessuto osseo (cellule ossee e ormoni sessuali), può determinare ulteriori effetti positivi sull’osso che risultano di estrema importanza per il benessere dell’individuo. Qui di seguito verranno elencati alcuni di questi:
‒ mantenere un buon livello di trofismo osseo che favorisce la prevenzione delle cadute e delle fratture;
‒ incrementare la funzionalità, la forza e la struttura muscolo-scheletrica che facilita la stabilità dell’individuo;
‒ avere maggiori stimoli meccanici esercitati sull’osso;
‒ ottenere la riduzione dei dolori muscolo-scheletrici particolarmente del dolore lombare con conseguente miglioramento dell’equilibrio fisico e la postura (73);
‒ migliorare e/o mantenere efficienti i riflessi, il senso di stabilità, la deambulazione, la coordinazione, propriocezione e il tempo di reazione, principalmente nelle persone anziane;
‒ controllare il movimento veloce e lento, l’indipendenza funzionale e la capacità cognitive (74);
‒ avere benefici immediati sullo stato di salute durante la crescita che influenzeranno positivamente la salute degli adulti, come per esempio i benefici su apparato cardiorespiratorio e circolazione del sangue permettendo così alle ossa di ricevere più
nutrienti;
‒ ottenere benefici sulla psiche (75);
‒ alleviare il disagio associato all’artrite e fibromialgia (76);
‒ aumentare il metabolismo energetico.
Esercizio fisico e metabolismo energetico
Per ciò che riguarda gli effetti positivi degli esercizi fisici sul metabolismo energetico, bisogna sottolineare che fare esercizio fisico vuole dire anche seguire una buona alimentazione, costituita essenzialmente da cibi contenenti carboidrati, grassi e proteine. Questi nutrienti, combinandosi con l’ossigeno, vengono trasportati dall’emoglobina alle cellule mediante il sistema cardiovascolare formando energia sotto forma di ATP; tale energia sarà rilasciata in seguito favorendo l’attività cellulare. Il rilascio di ATP nelle cellule muscolari permette a tali cellule di contrarsi per facilitare l’attività osteoblastica. La quantità di produzione di ATP è caratteristica per ogni nutriente, in quanto i singoli nutrienti, possedendo specifiche e uniche proprietà, determinano le quantità disponibile di ossigeno da usare come fonte energetica per improntare l’attività fisica al meglio (77).
Questo sottolinea la necessità di avere il sistema cardiovascolare in buono stato di salute che, permettendo di utilizzare bene i nutrienti, sviluppa quantità di ATP idonee a favorire l’attività osteoblastica e, conseguentemente, a prevenire e/o riparare i danni causati dall’osteoporosi.
Conoscenza del VO2max per stabilire l’attività fisica
Per valutare la disponibilità di ossigeno usato per un periodo di solido, intenso e specifico esercizio fisico, si utilizza il massimo consumo di ossigeno (VO2max). Il VO2max è un parametro biologico che esprime la quantità di ossigeno consumata quando un individuo è in esercizio fisico massimo in un dato periodo di tempo. Si tratta di un indicatore di fitness cardiopolmonare che aiuta a capire il livello di resistenza aerobica di una persona e, conseguentemente, consente di aumentare e/o monitorare le prestazioni sia di individui con elevate forze cardio-polmonari e perciò con elevati VO2max, sia di pazienti con diverse forze cardio-polmonari e quindi con diversi VO2max.
Dal momento che esiste una forte correlazione tra VO2max e HRmax (Heart Ratemax) per semplificare, molti allenatori e atleti durante un esercizio fisico, o persone che semplicemente camminano o corrono, usano tradizionalmente monitorare HRmax per valutare l’intensità di un allenamento (78).
Il VO2max è espresso in mL/kg/min (millilitri per kg di peso corporeo al minuto) ed è importante evidenziare che risulta tipico per alimento:
‒ VO2max è del 100% o vicino al 100% per carboidrati che sono la fonte primaria di energia per brevi prestazioni come per esempio lo sprint;
‒ VO2max è del 50% o meno del 50% per grassi e carboidrati che possono servire come
fonte di energia per la cellula in gare di resistenza. VO2max per le proteine non è identificabile in quanto sono raramente utilizzate come fonte di energia per attivare la potenza muscolare, mentre vengono utilizzate per mantenere e riparare i
tessuti del corpo come quello osseo, particolarmente sensibile al trascorrere dell’età (79).
Non solo è importante conoscere VO2max per alimento per avere maggiori prestazioni, ma è necessario stabilire per età, sesso e peso, l’entità e la durata di un aumento della spesa energetica; un’attività fisica intensa negli adulti, dopo 45 min, aumenta il tasso metabolico, che può implicare la perdita di peso; quindi, tale attività deve essere monitorata (80), anche se si è in presenza di una dieta equilibrata.
Da quanto descritto si sottolinea, ancor più, che l’amministrazione dell’attività fisica favorisce:
1) lo sviluppo e il mantenimento della struttura scheletrica durante l’infanzia, l’adolescenza e in età adulta sia in persone in buono stato di salute che non in buono stato di salute (81);
2) l’equilibrio dietetico, durante la vita di un individuo, può sostenere sia un giusto apporto energetico per eseguire un esercizio in regimi più efficaci sia un adeguato materiale di riparo per i danni subiti dall’osso.
ESERCIZI FISICI PER LA PREVENZIONE DELL’OSTEOPOROSI
Per comprendere quanto esposto fino ad ora, qui di seguito verranno elencati alcuni degli esercizi fisici che determinano il benessere dell’organismo, in particolar modo verranno evidenziati quelli riguardanti la salute del tessuto osseo.
Prima, però di descrivere gli esercizi fisici idonei per la prevenzione e/o cura dell’osteoporosi, per maggiore chiarezza, è bene fare un distinguo tra l’esercizio fisico e attività fisica che intende invece un’altra tipologia di movimento. I termini attività fisica ed esercizio fisico possono essere così distinti:
‒ Attività fisica
prevede tutti i movimenti del corpo che comportano un normale dispendio energetico come il camminare in modo regolare, le attività quotidiane, le faccende domestiche, il lavoro, fare le scale e la spesa;
‒ Esercizio fisico
prevede i movimenti ripetitivi, programmati e strutturati specificamente destinati al miglioramento della forma fisica e della salute che possono comprendere il nuoto, il camminare a ritmo sostenuto, l’andare in bicicletta, fare ginnastica aerobica e hobbies di natura attiva (es. il giardinaggio).
Per completezza, è da differenziare lo sport dall’attività fisica e dall’esercizio fisico che comporta, invece, situazioni competitive, strutturate e sottoposte a regole (82).
Generalmente, per la malattia osteoporotica, pur essendo una malattia cronico-degenerativa, può essere meglio adottare gli esercizi fisici mentre per le altre malattie cronico-degenerative l’attività fisica può essere più vantaggiosa. Tuttavia, questa distinzione deve essere valutata caso per caso secondo le necessità del singolo paziente sia se si tratta di osteoporosi e/o sia delle altre malattie-cronico-degenerative. Fatto questo distinguo, è importante evidenziare che ci sono due gruppi importanti di esercizi che, stimolando e mantenendo la massa e la densità ossea, aiutano a prevenire e/o curare l’osteoporosi:
‒ Resistance training exercises
Si tratta di allenamenti contro la resistenza, sono esercizi che usano la forza muscolare per migliorare la massa muscolare e rafforzare le ossa. Questi esercizi inducono i muscoli a contrarsi contro una resistenza esterna con l’aspettativa che l’osso aumenta il tono, la massa, la resistenza e la forza dove l’azione dei tendini, tirando sulle ossa, aumenta la resistenza e/o robustezza dell’osso. Generalmente, gli esercizi indicati per l’osteoporosi utilizzano flessioni, pesi (es. pesi liberi, macchine per pesi), attrezzature (es. manubri, sbarre, assi, corde) di una palestra per aumentare la massa muscolare e quindi favorire il potenziamento dell’osso. Per completezza, in base al tipo di allenamento, tali esercizi vengono detti anche allenamento di forza (strength training), allenamento con i pesi (weight training) o sollevamento pesi (weight lifting) (83). Dal tipo di esercizio si evince che si stratta di allenamenti fisici anaerobici, cioè con un’attività di potenza che si sviluppa in un breve lasso di tempo. Gli allenamenti anaerobici che si distinguono da quelli aerobici cioè con un’attività a bassa intensità e di lunga durata come i weight-bearing exercises che hanno lo scopo di migliorare la capacità di trasporto e utilizzo dell’ossigeno e di garantire un’ottimale gestione dei substrati energetici;
‒ Weight-bearing exercises
Si tratta di allenamenti di peso-rapporto in cui si sostiene il proprio peso in opposizione alla forza di gravità. Sono movimenti dove i piedi e le gambe sostenendo il peso provocano i muscoli e i tendini a tirare sul tessuto osseo contro la forza di gravità. A sua volta il tessuto osseo stimola le cellule osteoblastiche a produrre più osso. Il carico sulle ossa è creato tramite il proprio peso corporeo, come passeggiare, correre, ballare, saltare o fare jogging; in pratica, questi esercizi determinano una scossa al muscolo e osso come quando si mette un piede con forza sul terreno (84).
Per tutto questo, è giusto ribadire sia che l’esercizio fisico regolare dovrebbe iniziare dall’infanzia e adolescenza ed essere sostenuto durante il corso della vita, sia che è un’attività economica e sicura per migliorare la forza dell’osso permettendo la riduzione del rischio di fratture osteoporotiche.
Per compiere le varie tipologie di allenamenti, per la prevenzione e/o cura dell’osteoporosi, si devono, però, tenere presente vari fattori che vanno dalla fascia di età allo stato di salute delle persone, considerando se si tratta di prevenzione primaria o di prevenzione secondaria:
1) la prevenzione primaria avviene durante la crescita e l’adolescenza e gli esercizi, con un adeguato apporto di calcio e vitamina D, hanno lo scopo sia di ottenere un elevato BMP che di prevenire precocemente eventuali deformità scheletriche;
2) la prevenzione secondaria avviene durante la mezza età e gli esercizi proposti hanno lo scopo di ridurre il rischio di riassorbimento della massa ossea e conseguentemente il rischio di fratture osteoporotiche. La prevenzione secondaria, in realtà, è una prevenzione multifattoriali che riguarda, oltre agli esercizi, l’aspetto nutrizionale e l’aspetto farmacologico (85).
CONCLUSIONI
L’osteoporosi è una patologia cronico-degenerativa del metabolismo osseo che deve essere tenuta molto sotto controllo in quanto, intaccando la microstruttura del tessuto osseo, determina l’incremento della sua fragilità con conseguente aumento del rischio di fratture che conducono a morbidità e mortalità soprattutto in uomini e donne anziane (86). Da qui si comprende che una priorità importante nella prevenzione e cura dell’osteoporosi è lo sviluppo di terapie predittive per identificare e gestire i soggetti ad alto rischio di osteoporosi. Negli ultimi anni si è evidenziato che l’attività fisica, non è solo un efficace strumento di prevenzione per l’osteoporosi, ma è ormai diventata una precisa strategia di intervento nei confronti di persone con diverse tipi di malattia come le malattie cronico-generative, quali per esempio il diabete mellito di tipo 2, le CVD e le dislipidemie. Questo è importante in quanto l’attività fisica, non solo di per sé, ha effetti positivi diretti sul metabolismo osseo ma, agendo anche sulle malattie cronico-degenerative (22), può aiutare a gestire indirettamente l’osteoporosi.
Ciò pone la necessità che l’esercizio fisico dovrebbe essere inserito nel normale iter
preventivo e/o terapeutico per il trattamento di queste patologie da essere considerato come un farmaco “salvavita” a cui, per chi soffre di osteoporosi, dovrebbe rivolgersi particolarmente. Inoltre, la consapevolezza che non ci siano attualmente farmaci preventivi rende l’esercizio fisico un’attività di estrema utilità. In ogni caso, le evidenze suggeriscono che l’osteoporosi è più facile da prevenire che da guarire completamente anche in presenza di farmaci migliorativi e/o che la possono tenere sotto controllo. La gestione dell’attività fisica per l’osteoporosi è importante da intraprendere soprattutto da quando, dopo vari anni, all’osteoporosi è stata attribuita una giusta rilevanza clinica relazionata alla sua ingravescenza resa anche possibile dall’aumento significativo della vita media della popolazione. L’allungamento della vita ha dato maggiore visibilità a tale patologia, tanto da essere considerata un serio problema di sanità pubblica e socio-economico.
L’importanza della attività fisica è stata anche evidenziata dall’OMS che stima che circa 1,9 milioni di decessi in tutto il mondo sono attribuibili alla inattività fisica e che almeno 2,6 milioni di morti sono dovuti al sovrappeso o all’obesità (87), patologie che spesso si associano ad osteoporosi (88).
Inoltre, l’OMS ha reso noto che l’inattività fisica interviene per il 10-16% nel cancro del seno, colon e retto e nel diabete di tipo 2, e per il 22% nelle CVD; il peso di queste e di altre malattie croniche, inclusa l’osteoporosi, è rapidamente aumentato negli ultimi decenni (87).
Basta pensare che, solo in Italia, si stima che ci sono circa 3,5 milioni di donne e 1 milione di uomini affetti da osteoporosi e che oltre il 20% della popolazione, intorno ai 65 anni di età, presenta danni alla colonna vertebrale (8).
In conclusione, il sistema scheletrico è la struttura portante del nostro organismo ed è soggetto ad un continuo processo di rinnovamento attraverso una fase di distruzione del tessuto, seguita da una fase di ricostruzione delle strutture microscopiche dell’osso. L’alternanza di tali fasi porta il tessuto osseo ad essere più vulnerabile agli insulti esterni ambientali, rendendolo più soggetto a danni importanti come l’osteoporosi e le fratture ossee ad essa associate. Pertanto, è necessario che lo sviluppo delle ossa sia seguito e curato non solo in età adulta, ma anche durante la fase di accrescimento dell’adolescenza fino alla fase di raggiungimento del BMP e addirittura prima della nascita. Per tali motivi, un’importante strategia di conservazione dell’osso è il perseguire giusti e sani stili di vita fin dalla adolescenza che possono essere attuati anche prima che si manifesta la patologia ed eseguire attività fisica, può essere considerato un utile deterrente della perdita di massa ossea.
Per tutto ciò, l’attività fisica può essere considerata come un “farmaco” che opportunamente “somministrato” previene l’osteoporosi, garantendo considerevoli vantaggi sia alle singole persone, sia al Servizio Sanitario Nazionale riducendo le ospedalizzazioni e l’uso dei farmaci.
Estratto da:
Istituto Superiore di Sanità
Attività fisica nella prevenzione dell’osteoporosi.
Anna Velia Stazi
2015, 31 p. Rapporti ISTISAN 15/39
BIBLIOGRAFIA
1. Khosla S, Amin S, Orwoll E. Osteoporosis in men. Endocr Rev 2008;29:441-64.
2. Zimmermann KA. Skeletal system: facts, function & diseases. LiveScience; 2015.
3. Emkey RD, Emkey GR. Calcium metabolism and correcting calcium deficiencies. Endocrinol Metab Clin North Am 2012;41:527-56.
4. Macfarlane J. Other physical consequences of disability. Handb Clin Neurol 2013;110:315-22.
5. Sossi I, De Matteis D. Sindrome da immobilizzazione. Informazioni per degenti, parenti ed amici.
Trieste: Azienda-Ospedaliero Universitaria “Ospedali Riuniti”; 2013.
6. Smith R. In search of “non-disease”. BMJ 2002;324:883-5.
7. WHO. Prevention and management of osteoporosis. Geneva: World Health Organization; 2003.
(Technical Report Series n. 921).
8. Maggi S, Noale M, Giannini S, Adami S, Defeo D, Isaia G, Sinigaglia L, Filipponi P, Crepaldi G: ESOPO Study Group. Quantitative heel ultrasound in a population-based study in Italy and its
relationship with fracture history: the ESOPO study. Osteoporos Int 2006;17:237-44.
9. Rachner TD, Khosla S, Hofbauer LC. Osteoporosis: now and the future. Lancet 2011;377:1276-87.
10. Hadjidakis DJ, Il Bone remodeling. Ann N Y Acad Sci 2006;1092:385-96.
11. Stazi AV, Trecca A, Trinti B. Osteoporosis in celiac disease and in endocrine and reproductive disorders. World J Gastroenterol 2008;14:498-505.
12. Del Fattore A, Teti A, Rucci N. Bone cells and the mechanisms of bone remodelling. Front Biosci 2012;4:2302-21.
13. Prasad C, Imrhan V, Marotta F, Juma S, Vijayagopal P. Lifestyle and Advanced Glycation End products (AGEs) burden: its relevance to healthy aging. Aging Dis 2014;5:212-17.
14. Saulle R, Semyonov L, La Torre G. Cost and cost-effectiveness of the Mediterranean diet: results of a systematic review. Nutrients 2013;5:4566-86.
15. Hein GE. Glycation endproducts in osteoporosis–is there a pathophysiologic importance? Clin Chim Acta 2006;371:32-6.
16. Vistoli G, De Maddis D, Cipak A, Zarkovic N, Carini M, Aldini G. Advanced glycoxidation and lipoxidation end products (AGEs and ALEs): an overview of their mechanisms of formation. Free Radic Res 2013;47 Suppl 1:S3-27.
17. Viguet-Carrin S, Garnero P, Delmas PD. The role of collagen in bone strength. Osteoporos Int
2006;17:319-36.
18. Sanguineti R, Puddu A, Mach F, Montecucco F, Viviani GL. Advanced glycation end products play adverse proinflammatory activities in osteoporosis. Mediators Inflamm 2014;2014:975872.
19. Yang DH, Chiang TI, Chang IC, Lin FH, Wei CC, Cheng YW. Increased levels of circulating advanced glycation end-products in menopausal women with osteoporosis. Int J Med Sci 2014;11:453-60.
20. Marie PJ, Kassem M. Extrinsic mechanisms involved in age-related defective bone formation. J Clin Endocrinol Metab 2011;96:600-9.
21. Robert L, Labat-Robert J. Role of the Maillard reaction in aging and age-related diseases. Studies at the cellular-molecular level. Clin Chem Lab Med 2014;52:5-10.
22. Nishimune H, Stanford JA, Mori Y. Role of exercise in maintaining the integrity of the neuromuscular junction. Muscle Nerve 2014;49:315-24.
23. Jakobsen A, Laurberg P, Vestergaard P, Andersen S. Clinical risk factors for osteoporosis are common among elderly people in Nuuk, Greenland. Int J Circumpolar Health 2013;72:19596.
24. Raisz LG. Pathogenesis of osteoporosis: concepts, conflicts, and prospects. J Clin Invest 2005;115:3318–25.
25. Pagani F. I marcatori biochimici di rimodellamento osseo. Ligand Assay 2011;16:136-37.
26. Stazi AV. Micronutrient deficiencies in osteoporosis. Minerva Med 2013;104:455-70.
27. Nachtigall MJ, Nazem TG, Nachtigall RH, Goldstein SR. Osteoporosis risk factors and early life-style modifications to decrease disease burden in women. Clin Obstet Gynecol 2013;56:650-53.
28. Società Italiana di Nutrizione Umana. Livelli di assunzione giornalieri raccomandati di energia e nutrienti per la popolazione italiana. Revisione 1996. Roma: SINU; 2014.
29. Theobald HE. Dietary calcium and health. British Nutrition Foundation Nutrition Bulletin 2005;30:237-77.
30. Brini M, Carafoli E. Calcium pumps in health and disease. Physiol Rev 2009;89:1341-78.
31. Misra M, Pacaud D, Petryk A, Collett-Solberg PF, Kappy M. Vitamin D deficiency in children and its management: review of current knowledge and recommendations. Pediatrics 2008;122:398-417.
32. Gallagher RP, Lee TK, Bajdik CD, Borugian M. Ultraviolet radiation. Chronic Dis Can 2010;29
Suppl 1:51-68.
33. Sunyecz JA. The use of calcium and vitamin d in the management of osteoporosis. Ther Clin Risk
Manag 2008;4:827-36.
34. Mosekilde L, Vestergaard P, Rejnmark L. The pathogenesis, treatment and prevention of osteoporosis in men. Drugs 2013;73:15-29.
35. Nye AM, Hamrick I, Rauch A, Pound MW, Shelton PS. Documenting the use of calcium supplements with oral bisphosphonates. Consult Pharm 2013;28:31-8.
36. Dunn RL, Bird ML, Conway SE, Stratton MA. Use of bisphosphonates in older adults: how long is long enough? Consult Pharm 2013;28:39-57.
37. Ellis GK, Bone HG, Chlebowski R, Devchand P, Spadafora S, Smith J, Fan M, Jun S. Randomized trial of denosumab in patients receiving adjuvant aromatase inhibitors for nonmetastatic breast cancer.J Clin Oncol 2008:26;4875-82.
38. Eriksen EF, Keaveny TM, Gallagher ER, Krege JH. Literature review: the effects of teriparatide therapy at the hip in patients with osteoporosis. Bone 2014;67:246-56.
39. Montagnani A. Bone anabolics in osteoporosis: Actuality and perspectives. World J Orthop
2014;5:247-54.
40. Pfeifer M, Sinaki M, Geusens P, Boonen S, Preisinger E, Minne HW. Musculoskeletal rehabilitation in osteoporosis: a review. J Bone Miner Res 2004;19:1208-14.
41. Ryan AS, Ivey FM, Hurlbut DE, Martel GF, Lemmer JT, Sorkin JD, Metter EJ, Fleg JL, Hurley BF. Regional bone mineral density after resistive training in young and older men and women. Scand J Med Sci Sports 2004;14:16-23.
42. Nilsson M, Ohlsson C, Odén A, Mellström D, Lorentzon M. Increased physical activity is associated with enhanced development of peak bone mass in men: a five-year longitudinal study. J Bone Miner Res 2012;27:1206-14.
43. Hind K, Burrows M. Weight-bearing exercise and bone mineral accrual in children and adolescents: a review of controlled trials. Bone 2007;40:14-27.
44. Cipriani C, Romagnoli E, Carnevale V, Raso I, Scarpiello A, Angelozzi M, Tancredi A, Russo S, De Lucia F, Pepe J, Minisola S. Muscle strength and bone in healthy women: effect of age and gonadal status. Hormones 2012;11:325-32
45. Ralston SH, Uitterlinden AG. Genetics of osteoporosis. Endocrine Reviews 2010;31:629-62.
46. Liedert A, Kaspar D, Blakytny R, Claes L, Ignatius A. Signal transduction pathways involved in mechanotransduction in bone cells. Biochemical and Biophysical Research Communications 2006;349:1-5.
47. Sackin H. Stretch-activated ion channels. Kidney International 1995;48:1134-47.
48. Scott A, Khan KM, Duronio V, Hart DA. Mechanotransduction in human bone: in vitro cellular physiology that underpins bone changes with exercise. Sports Med 2008;38:139-60.
49. Khan KM. Mechanotransduction: how exercise heals at the tissue level. Br J Sports Med 2011;45:79.
50. Iolascon G, Resmini G, Tarantino U. Mechanobiology of bone. Aging Clin Exp Res 2013;25(Suppl1):S3-7.
51. Moriishi T, Komori T. Regulation of bone mass by osteocyte network. Clin Calcium 2012;22:705-12.
52. Eyckmans J, Boudou T, Yu X, Chen CS. A Hitchhiker’s Guide to Mechanobiology. Develepmental Cell 2011:21;35-47.
53. Isaacson J, Brotto M. Physiology of mechanotransduction: how do muscle and bone “talk” to one another? Clin Rev Bone Miner Metab 2014;12:77-85.
54. Arfat Y, Xiao WZ, Iftikhar S, Zhao F, Li DJ, Sun YL, Zhang G, Shang P, Qian AR. Physiological effects of microgravity on bone cells. Calcif Tissue Int 2014;94:569-79.
55. Clarke B. Normal bone anatomy and physiology. Clin J Am Soc Nephrol 2008;3 Suppl 3:S131-39.
56. Vico L, Collet P, Guignandon A, Lafage-Proust MH et al. Effects of long-term microgravity exposure on cancellous and cortical weight-bearing bones of cosmonauts. Lancet 2000;355:1607-11.
57. Zobel BB, Del Vescovo R, Oliva G, Russo V, Setola R. Assessing bone loss in micro-gravity: A fuzzy approach. Comput Methods Programs Biomed 2012;108:910-21.
58. Bu G, Shuang F, Wu Y, Ren D, Hou S. AQP9: a novel target for bone loss induced by microgravity. Biochem Biophys Res Commun 2012;419:774-8.
59. Aharon R, Bar-Shavit Z. Involvement of aquaporin 9 in osteoclast differentiation. J Biol Chem
2006;281:19305-9.
60. Bergmann P, Body JJ, Boonen S, Boutsen Y, Devogelaer JP, Goemaere S, Kaufman J, Reginster JY, Rozenberg S. Loading and skeletal development and maintenance. J Osteoporos 2010;2011:786752.
61. Nuti R, Martini G, Merlotti D, Valleggi F, De Paola V, Gennari L. Professional sport activity and micronutrients: effects on bone mass. J Endocrinol Invest 2005;28 (Suppl 10):S52-60.
62. Lumachi F, Camozzi V, Doretto P, Tozzoli R, Basso SM. Circulating PTH, Vitamin D and IGF-I levels in relation to bone mineral density in elderly women. In Vivo 2013;27:415-8.
63. Barrett-Connor E, Laughlin GA, Li H, Nielson CM, Wang PY, Dam TT, Cauley JA, Ensrud KE, Stefanick ML, Lau E, Hoffman AR, Orwoll ES. The association of concurrent vitamin D and sex hormone deficiency with bone loss and fracture risk in older men: the osteoporotic fractures in men (MrOS) study. J Bone Miner Res 2012;27:2306-13.
64. Wolff RB, Gomes RC, Verna C, Maioral GC, Rampazo TC, Simões RS, Baracat EC, Soares Júnior JM. Molecular features of sexual steroids on cartilage and bone. Rev Assoc Med Bras 2012;58:493-7.
65. Lobo RA, Davis SR, De Villiers TJ, Gompel A, Henderson VW, Hodis HN, Lumsden MA, Mack WJ, Shapiro S, Baber RJ. Prevention of diseases after menopause. Climacteric 2014;17:540-56.
66. Sood R, Faubion SS, Kuhle CL, Thielen JM, Shuster LT. Prescribing menopausal hormone therapy: an evidence-based approach. Int J Womens Health 2014;6:47-57.
67. Lee WL, Cheng MH, Tarng DC, Yang WC, Lee FK, Wang PH. The benefits of estrogen or selective estrogen receptor modulator on kidney and its related disease-chronic kidney disease-mineral and bone disorder: osteoporosis. J Chin Med Assoc 2013;76:365-71.
68. Mirkin S, Pickar JH. Selective estrogen receptor modulators (SERMs): A review of clinical data. Maturitas 2015;80:52-57.
69. Ohta H. Updates on lifestyle-related diseases and bone metabolism. Efficacy of selective estrogen receptor modulators (SERMs) in lifestyle-related osteoporosis. Clin Calcium 2014;24:1679-87.
70. Rutanen R, Luoto R, Raitanen J, Mansikkamäki K, Tomás E, Nygård CH. Short- and long-term effects of a physical exercise intervention on work ability and work strain in symptomatic menopausal women. Saf Health Work 2014;5:186-90.
71. Aizawa K, Iemitsu M, Maeda S, Mesaki N, Ushida T, Akimoto T. Endurance exercise training enhances local sex steroidogenesis in skeletal muscle. Med Sci Sports Exerc 2011;43:2072-80.
72. Labrie F. All sex steroids are made intracellularly in peripheral tissues by the mechanisms of intracrinology after menopause. J Steroid Biochem Mol Biol 2015;145:133-8.
73. Jakobsen MD, Sundstrup E, Brandt M, Jay K, Aagaard P, Andersen LL. Effect of workplace- versus home-based physical exercise on musculoskeletal pain among healthcare workers: a cluster randomized controlled trial. Scand J Work Environ Health 2015;41:153-63.
74. Garber CE, Blissmer B, Deschenes MR, Franklin BA, Lamonte MJ, Nieman DC, Swain DP. Quantity and quality of exercise for developing and maintaining cardiorespiratory, musculoskeletal, and neuromotor fitness in apparently healthy adults. Med Sci Sports Exerc 2011;43:1334-59.
75. Loprinzi PD, Cardinal BJ, Loprinzi KL, Lee H. Benefits and environmental determinants of physical activity in children and adolescents. Obes Facts 2012;5:597-610.
76. Kelley GA, Kelley KS, Hootman JM. Effects of exercise on depression in adults with arthritis: a systematic review with meta-analysis of randomized controlled trials. Arthritis Res Ther 2015;17:21.
77. Kenney WL, Wilmore JH, Costill DL. Physiology of sport and exercise. 5th ed. Champaign, IL:
Human Kinetics; 2012.
78. Zavorsky GS. Evidence and possible mechanisms of altered maximum heart rate with endurance
training and tapering. Sports Med 2000;29:13-26.
79. Quinn E. Energy pathways for exercise – how carbohydrate, fat and protein fuels exercise. Sports
Nutrition; 2008.
80. Gibala MJ, Gillen JB, Percival ME. Physiological and health-related adaptations to low-volume interval training: influences of nutrition and sex. Sports Med 2014;44 Suppl 2:S127-37.
81. Knab AM, Shanely RA, Corbin KD, Jin F, Sha W, Nieman DC. A 45-minute vigorous exercise bout
increases metabolic rate for 14 hours. Med Sci Sports Exerc 2011;43:1643-648.
82. Caspersen CJ, Powell KE, Christenson GM. Physical activity, exercise, and physical fitness:
definitions and distinctions for health-related research. Public Health Rep 1985;100:126-31.
83. Langford GA, McCurdy KW, Ernest JM, Doscher MW, Walters SD. Specificity of machine, barbell,
and water-filled log bench press resistance training on measures of strength. J Strength Cond Res
2007;21:1061-6.
84. Siegrist M. Role of physical activity in the prevention of osteoporosis. Med Monatsschr Pharm 2008;31:259-64.
85. Pigozzi F, Rizzo M, Giombini A, Parisi A, Fagnani F, Borrione P. Bone mineral density and sport: effect of physical activity. J Sports Med Phys Fitness 2009;492:177-83
86. Jackuliak P, Payer J. Osteoporosis, fractures, and diabetes. Int J Endocrinol 2014;2014:820615.
87. Dobbins M, Husson H, DeCorby K, LaRocca RL. School-based physical activity programs for promoting physical activity and fitness in children and adolescents aged 6 to 18. Cochrane Database Syst Rev 2013;2:CD007651.
88. Shapses SA, Sukumar D. Bone metabolism in obesity and weight loss. Annu Rev Nutr 2012;32:287-309

© 2la.it - Riproduzione riservata.



